
https://www.sinotechmachinery.com/products/two-stage-multi-stage-fermenter-10l-100l-automatic-sip/
A produção comercial de proteínas terapêuticas recombinantes envolve tipicamente a cultura de suspensão de células de mamíferos em biorreatores com volumes de até 10.000 L. Com os avanços na engenharia celular, desenvolvimento de mídia basal e alimentada e engenharia de bioprocessos nos últimos 30 anos, títulos de expressão ~ 10g/L, densidades de células viáveis> 3 × 10 ^ 7 células/mL e produtividade de células unitárias> 20 pg/célula/dia agora é comum. Essas altas densidades celulares (potencialmente mais altas) aumentam os requisitos de mistura e aeração e podem submeter as células a um ambiente hostil sujeito a altos estresses hidrodinâmicos. Anteriormente nesta parte da série de cursos de expansão do biorreator, esta parcela fornece uma compreensão básica do fluxo de fluido, mistura e transferência de massa em biorreatores, e como a interação desses parâmetros cria o ambiente em que as células existem. Isso pode afetar significativamente o crescimento celular, o metabolismo e a produção de proteínas.
Fluxo de fluido em biorreator:
Fluidos (líquidos ou gases) são substâncias que se deformam continuamente quando submetidas a forças de cisalhamento. Cisalhamento causa deformação, uma mudança nas posições relativas dos componentes do fluido. Esta força deve ser aplicada para criar fluxo de fluido. Os cientistas classificam os fluidos com base em sua densidade e viscosidade
• Compressível (ou incompressível)-se sua densidade muda com a pressão, os gases são geralmente compressíveis, os líquidos são incompressíveis
• Viscosidade (todos os fluidos têm uma viscosidade finita, que é a causa do "atrito interno" durante o fluxo, ou expressa como a resistência do fluido ao movimento)
• Newtoniano ou não newtoniano, dependendo se eles obedecem à lei de viscosidade de Newton.
A tensão de cisalhamento é calculada dividindo a força de cisalhamento exercida sobre o fluido pela área da seção transversal onde a força é aplicada. Estritamente falando, a tensão de cisalhamento é uma das duas dinâmicas de fluidos básicas, sendo a outra "tensão normal". Ambos são geralmente determinados multiplicando a viscosidade pelo gradiente de velocidade, com a direção do fluxo sendo vertical para tensão de cisalhamento e paralela para tensão normal. Portanto, para tensão de cisalhamento, o gradiente de velocidade é escrito como dUx/dy e para tensão normal, o gradiente de velocidade é escrito como dUx/dx, onde U é a velocidade do fluido e x e y representam a direção da força/tensão.
Quando um fluido flui através de um tubo ou objeto sólido, a velocidade do fluido muda dependendo da localização. Por exemplo, uma camada de fluido em contato com uma parede de tubo é assumida como tendo a mesma velocidade que a parede ou objeto sólido (velocidade zero). Devido ao movimento geral do fluido, a próxima camada de fluido para dentro tem uma velocidade ligeiramente maior, a camada mais para dentro tem uma velocidade mais rápida e assim por diante. Em cada fluido, as partículas são constantemente trocadas entre essas camadas, o que afeta a rapidez com que fluem. As partículas que se movem de uma camada de movimento lento para uma camada mais rápida têm sua velocidade reduzida; as partículas que se movem de uma camada rápida para uma camada mais lenta têm um efeito de aceleração. Portanto, o fluxo de fluido cria tensão de cisalhamento devido às diferenças de velocidade.
Dependendo da velocidade do fluido, o fluxo pode ser classificado como laminar ou turbulento. Quando o movimento geral do fluido é lento, as camadas adjacentes de fluido se movem em um movimento ordenado (mais ou menos paralelo), chamado fluxo laminar. Em fluidos de fluxo rápido, partículas de fluido e aglomerados de fluido freqüentemente fluem aleatória e caoticamente através das camadas em um fluxo turbulento.
O número de Reynolds (Re) é uma variável adimensional usada para descrever se o movimento do fluido é laminar ou turbulento. A Equação 1 calcula Re para fluxo de fluido em um tubo de seção transversal circular:
Re = DUρ/μ, onde D é o diâmetro do tubo, U é a velocidade do fluido e ρ e μ são a densidade e a viscosidade do fluido, respectivamente.
Uma vez que a indústria biofarmacêutica está principalmente interessada no fluxo de fluidos emFermentador mexido mecanicamente, O número de Reynolds relevante é definido pela Equação 2:
Rei = Ni Di2ρ/μ, onde Ni é a velocidade do impulsor, Di é o diâmetro do impulsor e ρ e μ são a densidade e viscosidade do fluido, respectivamente.
Conceitualmente, o número de Reynolds representa a proporção de forças inerciais para forças viscosas. Durante laminarFluxo (números baixos de Reynolds), forças viscosas dominam e o fluido se move lentamente. No entanto, à medida que o número de Reynolds aumenta, as forças inerciais se tornam mais dominantes e o fluxo passa de laminar para turbulento-e então para totalmente turbulento em valores de Re suficientemente altos.
Se Re < 2100, o fluxo do tubo é laminar. Para valores de Re de 2000-4000, o fluxo é considerado no regime de transição de laminar para turbulento. Uma vez Re > 4000, o fluxo é totalmente turbulento. Em um tanque agitado, o valor Re que marca a transição do fluxo laminar para o turbulento depende da geometria do tanque e do impulsor.
Turbulência em Biorreatores:
Turbulência é o regime de fluxo encontrado pelas células emBiorreatores de biotecnologia... A turbulência é essencial para a mistura eficiente (transferência de massa e calor no fluido), portanto, alcançar condições turbulentas no biorreator é fundamental para uma cultura bem-sucedida. Como mencionado acima, o número de Reynolds representa o tempo durante o qual a turbulência se desenvolve. À medida que esse número aumenta, as forças inerciais começam a dominar as forças viscosas no fluido, superando a tendência dos efeitos viscosos de suprimir as instabilidades de fluxo. A turbulência pode, portanto, ser vista como um movimento de fluido altamente desordenado resultante do crescimento de instabilidades em um campo de fluxo inicialmente laminar.
A turbulência é inerentemente muito complexa e nossa compreensão dela está longe de ser completa. O fluxo tem uma direção geral, mas em cima disso estão sobrepostos movimentos caóticos secundários de partículas de fluido, causando desvios de fluxo e gerando redemoinhos de formas, tamanhos, velocidades e direções de rotação variadas. Esses movimentos secundários irregulares em turbulência têm um impacto significativo na eficiência de mistura, perdas de energia e intensidade de cisalhamento. A turbulência forma estruturas fluidas rotativas chamadas redemoinhos, que podem se esticar, coalescer e se quebrar. A velocidade do fluido dentro de um redemoinho sofre grandes mudanças de magnitude e direção em distâncias e tempos relativamente curtos.
Eddies de tamanhos variados ocorrem em fluxo turbulento. O tamanho dos maiores redemoinhos é limitado pelos limites do sistema de fluxo. Assim, o diâmetro dos maiores redemoinhos em um biorreator é semelhante (mas ligeiramente menor que) o diâmetro do vaso do reator. Grandes redemoinhos são instáveis e dão origem a redemoinhos menores, que por sua vez dão origem a redemoinhos menores e assim por diante. Em um biorreator agitado, a energia dos grandes redemoinhos vem do fluxo a granel gerado pelos impulsores, de modo que eles contêm a maior parte da energia cinética turbulenta. Os menores redemoinhos são incapazes de manter o movimento rotacional e perder energia como calor devido aos efeitos da viscosidade e do atrito do fluido. Portanto, manter a turbulência requer um fornecimento contínuo de energia para substituir a energia perdida como calor.
Dispersão é o processo de quebrar o fluxo de volume em redemoinhos cada vez menores para facilitar o transporte rápido de material por toda a embarcação. O grau de uniformidade que pode ser produzido pela dispersão é limitado pelo tamanho do menor redemoinho que se forma. Assumindo turbulência isotrópica no vaso agitado e que o fluxo é turbulento (NRei > 104 ), o tamanho do menor redemoinho é aproximadamente igual à escala de mistura de Kolmogorov (λ) ou escala de turbulência, definido pela Equação 3:
Λ = (ν3/ε)1/4
Onde λ é o comprimento característico do menor redemoinho, ν é a viscosidade cinemática do fluido e ε é a taxa de dissipação de energia turbulenta local por unidade de massa do fluido.
No estado estacionário, a taxa média de dissipação de energia turbulenta em todo o biorreator é igual à entrada de energia para o fluido do tanque pelo impulsor. Portanto, quanto maior a entrada de energia para o impulsor, menores os redemoinhos. Uma vez que λ depende da viscosidade, para uma determinada entrada de energia, redemoinhos menores são gerados em meios de baixa viscosidade. Para uma entrada de energia de 0,1 W/kg (atualmente considerada alta para cultura de células animais), o diâmetro parasita mínimo λ é estimado em cerca de 0,06mm (60 μm). Isso representa a escala de mistura mínima alcançável por dispersão sob essas condições.
O comprimento característico (λ) do menor redemoinho é freqüentemente um indicador do potencial de dano celular devido ao cisalhamento do fluido. Experimentos mostraram que se entidades biológicas (por exemplo, células de mamíferos) em um biorreator forem menores do que λ, danos por cisalhamento a tais entidades não ocorrerão. Minow et al. compararam a mistura e a transferência de massa em dois biorreatores de uso único de 1000 L diferentes. Os autores calcularam a escala de Kolmogorov para o menor redemoinho presente em cada tipo de biorreator.
Conforme mostrado na Tabela 1, os valores de λ calculados para cada tipo de biorreator foram próximos a 80 μm-muito maiores do que o tamanho de 15 μm do ovário de hamster chinês (CHO) células usadas neste estudo. Da mesma forma, Godoy-SilvA et al. descreveu células CHO que podem suportar ≤ 6000 W/kg de entrada de energia. Em taxas de dissipação de energia> 300 W/kg, que ainda é muito maior do que a densidade de potência dos reatores comerciais de cultura celular, o único efeito observado foi o padrão de glicosilação da proteína expressa, mas as células não foram afetadas. Embora esses resultados se apliquem apenas ao sistema estudado, eles ainda sugerem que os danos por cisalhamento foram superestimados nas últimas décadas. Nienow chegou à mesma conclusão em dois artigos diferentes. Portanto, é seguro dizer que redemoinhos menores que 10-20 μm (menores do que o tamanho típico de células de mamíferos) têm muito pouca energia cinética turbulenta, enquanto redemoinhos maiores simplesmente carregam células em convecção.
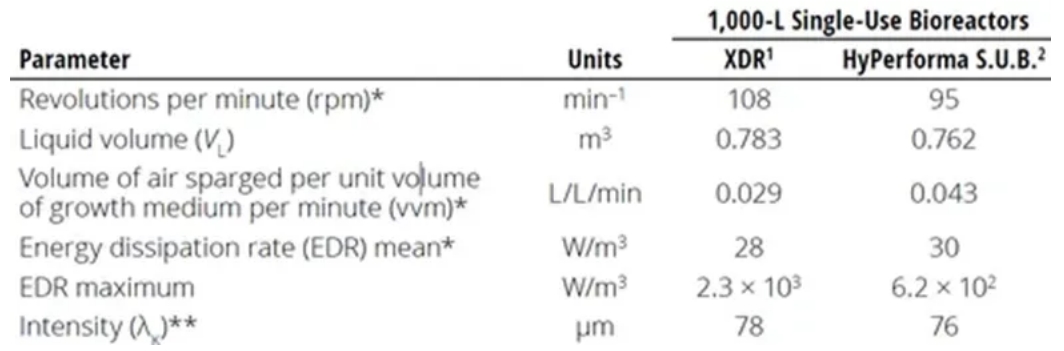
Tabela 1: Comparação de parâmetros para calcular a tensão dinâmica de fluido em dois biorreatores de uso único de 1000L diferentes. * Valores máximos no processo no tamanho atual do biorreator ** Calculado a partir das médias de EDR
A mistura é uma operação física que reduz a não homogeneidade do fluido, eliminando gradientes na temperatura, concentração e outras propriedades. Durante a mistura, a troca de material entre diferentes locais em um vaso (por exemplo, um vaso de mistura ou biorreator) resulta em “mistura” de componentes. A mistura é amplamente utilizada no bioprocessamento, por exemplo
• Misturar componentes solúveis de meios de cultura em pó com água em preparação para cultura de células • Dispersar gases como ar e oxigênio através de um líquido na forma de bolhas • Manter a suspensão de partículas sólidas, como células ou agregados celulares (e.g., em microtransportadores) • Facilitando a transferência de calor de ou para um líquido.
A mistura é uma das operações unitárias mais importantes no bioprocessamento. Não é suficiente simplesmente carregar umFermentador biorreatorCom meios de cultura ricos em nutrientes e células. A menos que o conteúdo do biorreator seja bem misturado, as células se assentarão e as zonas de depleção de nutrientes se formarão à medida que consomem rapidamente as substâncias de que precisam em seu ambiente local. A mistura controla o acesso das células a nutrientes dissolvidos e oxigênio e também desempenha um papel fundamental no controle da temperatura da cultura. O equipamento de mistura tem um impacto significativo na eficiência da mistura, afetando diretamente os requisitos de energia e os custos operacionais. O desenvolvimento da dinâmica de fluidos no meio de cultura e outros fluidos impulsiona processos de aeração, como colapso de bolhas, aprisionamento de gás e dispersão uniforme de bolhas. Portanto, a mistura pode determinar o sucesso de um bioprocesso.
Geometria do biorreator: A maioria dos grandes biorreatores de aço inoxidável (ou reutilizáveis) são cilíndricos com uma relação altura/diâmetro do tanque (H/T) >1. Os defletores (tiras de metal cilíndricas) são montados nas paredes do biorreator para reduzir redemoinhos e redemoinhos no líquido. A mistura é obtida por impulsores montados em um eixo do agitador central acionado por um motor. Os impulsores rotativos bombeiam e forçam o líquido a se dispersar dentro do reator, criando um padrão de fluxo regular que circula pelo vaso e retorna periodicamente à área do impulsor. Para aeração, o gás (geralmente ar e/ou oxigênio) é introduzido no vaso por meio de um espargador localizado abaixo do impulsor. Para biorreatores cilíndricos, o espaço superior é tipicamente 20-30% do volume total do vaso.
A forma do fundo do tanque agitado afeta a eficiência de mistura. A maioria dos biorreatores agitados tem fundos arredondados em vez de planos para evitar cantos agudos e depressões nas quais o fluxo de fluido pode entrar, evitando assim a formação de zonas estagnadas. A energia necessária para manter os sólidos (como as células) suspensos em um tanque agitado também depende da forma do fundo do vaso. Para uma mistura eficaz com um único impulsor, o diâmetro do impulsor (Di) deve estar entre 0,25 e 0,50 do diâmetro do tanque (T) e a altura do líquido (HL) deve estar entre 1,0 e 1,25 de T. Isso ocorre porque a intensidade da mistura diminui rapidamente à medida que o fluido sai da área do impulsor, portanto, grandes volumes de líquido na parte superior do vaso (longe do impulsor) são difíceis de misturar-então isso deve ser evitado. Outro aspecto da geometria do vaso que afeta a eficiência da mistura é a lacuna (C) entre o impulsor e o fundo do tanque, que afeta a suspensão sólida, a dispersão do gás e a estabilidade hidrodinâmica. Para a maioria dos sistemas de biorreator de tanque agitado, a razão de abertura para altura do fluido (C/HL) está normalmente na faixa de 0, 33-0, 66.
O tipo de impulsão é fundamental para o design do biorreator. O sistema de impulsor deve ser capaz de fornecer energia suficiente ao meio de cultura de células para alcançar uma boa eficiência de mistura, uniformidade e transferência de massa adequada para atender às demandas de oxigênio das células. Figura 3 mostra os dois moSão projetos de impulsor comuns usados em biorreatores reutilizáveis e de uso único: o impulsor Rushton e o impulsor de lâmina inclinada. À medida que as lâminas do impulsor giram, elas empurram contra o fluido adjacente. Esta ação cria áreas de alta pressão na superfície frontal e áreas de baixa pressão atrás das lâminas. Essas áreas são responsáveis pelo movimento do fluido dentro do biorreator e, em última análise, pela mistura do fluido. O fluido longe do impulsor geralmente mantém uma pressão constante.
Lâminas de pitch e impulsores Rushton são comumente usados em biorreatores.
A velocidade do fluido é mais alta na ponta da lâmina e diminui rapidamente para longe do impulsor. Conforme o impulsor gira, ele cria velocidade de rotação no fluido circundante, que pode ser observada como uma região de alta velocidade próxima ao impulsor. A lâmina do impulsor Rushton também induz o fluxo radial para fora nas proximidades. Ele extrai fluido das regiões superior e inferior do biorreator, criando um movimento circular dentro do vaso. Este movimento aumenta a mistura de fluidos. Em contraste, os impulsores de lâmina inclinada criam principalmente fluxo axial.
O projeto de impulsor preferido para biorreatores de cultura de células é usar lâminas inclinadas (com um diâmetro de lâmina ideal e velocidade de agitação) porque as lâminas são propensas a danos por cisalhamento. Os impulsores de lâmina inclinado criam principalmente fluxo axial, mas também podem equilibrar os padrões de fluxo axial e radial se as lâminas forem configuradas de forma adequada.
O fluxo axial é necessário para a mistura de cima para baixo em biorreatores de tanques agitados e impulsores de lâmina inclinada (onde as lâminas estão em um ângulo de menos de 90 ° em relação ao plano de rotação) pode efetivamente criar esse fluxo. O fluido que sai do impulsor é conduzido para baixo até que seja desviado do fundo do vaso. O fluido então se espalha e flui para cima ao longo da parede do vaso antes de ser puxado de volta para o impulsor. O fluxo giratório requer defletores para quebrar os vórtices que se formam ao longo das paredes do vaso.
Os impulsores de lâmina de passo, quando agitados em velocidades suficientemente altas em meios de baixa viscosidade, como água e meios de cultura de células, produzem uma região turbulenta de alto cisalhamento e rápida mistura perto do impulsor. Esta região de alto cisalhamento é responsável pelo colapso da bolha em biorreatores usando faíscas. A energia cinética turbulenta não é distribuída uniformemente por todo o tanque, com os valores mais altos ocorrendo principalmente na região próxima ao impulsor. Os níveis de energia cinética turbulenta no resto do tanque, longe do impulsor, são uma ordem de magnitude inferior aos valores máximos medidos.
O fluxo axial é útil quando um fluxo vertical forte é necessário-por exemplo, para suspender sólidos ou células em um fluido. A capacidade de operar impulsores de pás de passo no modo de fluxo ascendente ou descendente é um requisito importante, e os motores bidirecionais podem fornecer essa capacidade. Para a maioria dos sistemas de cultura de células animais, esses impulsores são definidos para o modo de bombeamento de fluxo ascendente. No entanto, a opção de fluxo descendente pode ser usada para suspender culturas de células aderentes em microtransportadores em baixas velocidades e entrada de energia específica baixa para evitar que as células caiam dos portadores.
Impulsores montados em disco com seis lâminas retas, comumente conhecidas como turbinas Rushton, produzem fluxo radial. Eles são freqüentemente usados em fermentações microbianas porque podem gerar forças de cisalhamento muito altas, proporcionando assim uma dispersão de gás eficiente. As turbinas Rushton produzem um fluxo de líquido de alta velocidade radialmente para fora do impulsor em direção à parede do tanque.
O fluido é dividido ao meio, com um fluindo para cima e o outro fluindo para baixo em direção ao fundo do tanque. O fluxo geral no vaso, portanto, consiste em dois grandes vórtices anulares, um acima do impulsor e outro abaixo dele.
Outra característica dos impulsores Rushton é que eles produzem um vórtice posterior no fluido atrás da borda horizontal de cada lâmina plana do impulsor. Os eddies desempenham um papel crucial na determinação do desempenho da mistura, uma vez que a maior parte da mistura ocorre nas proximidades dos vórtices produzidos pelas lâminas do impulsor. Esses vórtices à direita também fornecem dispersão de gás em sistemas distribuidores de gás. Os gradientes de velocidade íngremes associados são a principal fonte de turbulência. Uma das razões pelas quais os impulsores de Rushton são amplamente usados em fermentadores microbianos é sua capacidade de lidar com altas taxas de fluxo de gás e fornecer dispersão de gás eficiente.
A potência necessária para atingir uma determinada velocidade do agitador depende do atrito e do arrasto do formulário (causado pela diferença de pressão entre a frente e a traseira das pás do impulsor), que resistem ao impulsor de girar. O atrito e o arrasto de forma produzem um torque no eixo do agitador. A entrada de potência pode ser determinada experimentalmente medindo o torque induzido (Equação 4):
P = 2 πNiM
Onde P é potência, Ni é a velocidade do impulsor e M é torque.
A potência necessária para misturar líquidos sem gases depende do agitadorVelocidade, forma e tamanho do impulsor, geometria do tanque e densidade e viscosidade do líquido. A relação entre essas variáveis é geralmente expressa como uma potência adimensional (Equação 5):
NP = P/ρNi3Di5
Onde NP é o número de potência, P é a potência, Ni é a velocidade do impulsor e Di é o diâmetro do impulsor.
O número de potência é análogo ao coeficiente de arrasto de um sistema agitado. A relação entre NP e Re é geralmente determinada experimentalmente para uma variedade de configurações de impulsor e tanque. Uma vez que o fluxo se torna turbulento, o número de potência para diferentes projetos de impulsor torna-se constante. Sob condições turbulentas em tanques agitados, o número de potência para um impulsor Rushton é geralmente constante em 5, enquanto o número de potência para um impulsor de lâmina com inclinação axial é de aproximadamente 1. Portanto, um impulsor Rushton tem um forte arrasto de forma, produz alto torque, E transmite mais potência na mesma velocidade de operação em comparação com um impulsor de lâmina inclinado.
Fluxo de fluido: As lâminas rotativas do impulsor bombeiam o fluido no vaso do biorreator. A taxa de fluxo de volume do fluido que sai do impulsor é uma característica do projeto do impulsor e varia com os parâmetros operacionais, como velocidade do impulsor e tamanho do impulsor. O número de fluxo adimensional indica a eficácia do processo de bombeamento (Equação 6):
Nflow = Q/NiDi3
Onde Q é a taxa de fluxo de volume do fluido deixando as lâminas do impulsor, Ni é a velocidade do impulsor e Di é o diâmetro do impulsor.
Para a mesma potência de entrada, um impulsor de lâmina inclinada produz quase 3 a 4 vezes a taxa de fluxo de um impulsor Rushton. É por isso que o primeiro projeto é considerado como tendo alta capacidade de bombeamento e eficiência de operação de mistura, enquanto o último é considerado como tendo menor eficiência de bombeamento.
Para uma boa mistura em um vaso agitado, a velocidade do fluido que sai do impulsor deve ser suficiente para transportar o material para as áreas mais distantes do vaso. O fluido circulante também deve varrer todo o vaso em um período de tempo razoável. O fluxo de fluido deve ser turbulento para obter uma boa mistura, que pode ser descrita como uma combinação de três processos físicos (1): distribuição, dispersão e difusão. A distribuição também é chamada de "macromixing" e a difusão é chamada de "micromixing". A dispersão pode ser classificada como macromixing ou micromixing, dependendo da escala do movimento do fluido.
Distribuição é o processo pelo qual um fluido é transportado para todas as áreas de um vaso agitado pelo fluxo de circulação em massa. É um processo importante no processo de mistura e geralmente é a etapa mais lenta porque o fluido tem uma longa distância para percorrer em um longo caminho de circulação. A dispersão divide o fluxo de volume em redemoinhos cada vez menores, o que ajuda o material a se mover rapidamente pela embarcação. O grau de uniformidade que pode ser produzido por dispersão é limitado pelo tamanho do menor redemoinho que pode se formar em um determinado fluido. Para conseguir uma mistura menor que o menor redemoinho, a difusão se torna um processo importante. Essa micromixação ocorre de forma relativamente rápida e em distâncias mais curtas do que aquelas envolvidas na distribuição.
O tempo de mistura (tm) é um parâmetro útil para avaliar a taxa de mistura geral em um vaso agitado. É o tempo necessário para atingir um determinado grau de uniformidade, começando com materiais completamente separados. O tempo de mistura pode ser medido injetando um material traçador (geralmente uma solução de ácido, base ou sal concentrada) no vaso e rastreando sua concentração em um ponto fixo no vaso.
Quando um pequeno pulso traçador é adicionado a um fluido em um tanque agitado que já contém uma certa concentração (Ci) de material traçador, uma curva de resposta de concentração como a da Figura 6 pode ser esperada. Concentrações relativamente altas são detectadas cada vez que o fluxo em massa carrega o traçador para o ponto de medição antes que a mistura seja concluída. O tempo entre os picos de concentração é aproximadamente igual ao tempo médio necessário para o fluido atravessar uma alça de circulação geral, chamada de tempo de ciclo (tc ). Após vários ciclos, a uniformidade desejada será alcançada.
Depois que o corante traçador é injetado no tanque agitado, o tempo de mistura (tm) é determinado com base na resposta da concentração (C); Cf = concentração final, Ci = concentração intermediária, tc = tempo de ciclo.
O tempo de mistura é geralmente expresso como o tempo em que a concentração traçadora difere de sua concentração final (Cf) em menos de 5-10% da diferença de concentração total (Cf -Ci ). Em tm, a concentração do traçador é relativamente estável e a composição do fluido é próxima da uniforme. Para biorreatores em escala industrial, isso leva vários minutos.
A mistura da fase líquida é crítica na biorea em grande escalaCtors porque, na maioria dos casos, ingredientes de ração, bases ou agentes antiespumantes são adicionados na superfície superior do fluido. Essas adições devem ser distribuídas rapidamente por toda a cultura para alcançar a uniformidade sem induzir gradientes de concentração locais. O processo de homogeneização é governado pelo padrão de fluxo dominante e informações sobre as condições gerais de mistura no biorreator podem ser obtidas a partir da medição tm.
Um estudo sobre biorreator em grande escala
Rs usando a técnica de descoloração de iodo foi relatado por Sieblist et al. Os dados na Figura 7 mostram que os padrões de descoloração espacial e as velocidades de descoloração dos diferentes tipos de impulsor variam muito na mesma entrada de energia, usando três impulsores Rushton e três impulsores de lâmina inclinada. Esses resultados fornecem evidências experimentais de que os impulsores que induzem o fluxo axial podem reduzir o tm em cerca de um fator de dois. A razão é que os impulsores da lâmina inclinada que bombeiam axialmente para baixo induzem uma estrutura de fluxo mais extensa, o que melhora significativamente a mistura de cima para baixo; o impulsor Rushton causa regionalização de fluxo, resultando em uma diminuição na eficiência geral de mistura, de modo que o tempo de mistura é mais longo.
Tempo de mistura (tm) determinado em um biorreator de 400 L equipado com três impulsores Rushton (círculos) ou três impulsores de lâmina inclinada (triângulos); os dados se encaixam na correlação relatada por Ruszkowski; D = diâmetro do impulsor, H = altura da embarcação, T = diâmetro da embarcação, Ε = taxa de dissipação de energia turbulenta local por unidade de massa de fluido, 095% = tempo necessário para atingir 95% de homogeneidade no biorreator.
Uma descoberta surpreendente deste estudo é que o tempo de mistura depende apenas da geometria do biorreator e não do sistema de agitação. Diferentes configurações de impulsor afetam o fator constante (10,5 ou 17,9) na correlação empírica de Ruszkowski. Outro experimento relatado por Sieblist et al. mostrou que o tempo de mistura depende criticamente das condições experimentais, em particular da localização da adição do traçador no biorreator. A Figura 8 mostra que adicionar traçador próximo aos impulsores tem um efeito muito maior do que adicioná-lo no ponto de controle (superfície líquida), o que reduz o tempo de mistura. Isto demonstra a importância da adição de substratos e agentes corretivos (por exemplo, bases e antiespumas) à cultura próxima às pás de agitação, de modo que eles possam ser rapidamente distribuídos por toda a cultura. As implicações disso foram compreendidas há muito tempo; no entanto, não é uma prática universal.

 English
English français
français Español
Español русский
русский português
português العربية
العربية Deutsch
Deutsch tiếng việt
tiếng việt 한국어
한국어 Türkçe
Türkçe Malay
Malay





